Gases Reales
La
grafica que se muestra a continuación representa el comportamiento de
licuefacción de un gas
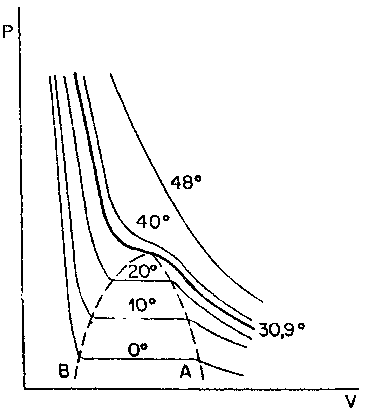
Fases existentes en los diferentes tramos de una curva
Para
esto llamaremos “curva u-v”
a la isoterma en 0oC
Curva
“w-x”
a la isoterma en 30,9oC y,
Curva
“y-z” a la isoterma en 48oC
Las
fases en la curva u-v son: desde “u” hasta el principio de la campana
de saturación es líquido, dentro del domo de saturación, la fase es de
líquido – Vapor, y cuando la curva sale del domo, lo hace en estado
gaseoso.
Las
fases en la curva w-x son: desde “w” hasta
el punto máximo del domo de saturación es líquida, en el punto máximo,
la fase es mixta; líquido – vapor, y a partir del punto, es gaseosa.
En
la isoterma de 48oC existe una sola fase, la cual es constante;
la gaseosa, ya que la isoterma está por encima del punto crítico de la
temperatura.
Cuál es la diferencia básica que presentan las curvas a medida que se aumenta la temperatura
A
medida que se aumenta la temperatura, el líquido se convierte en vapor
hasta llegar a gas
Que nombre recibe la curva segmentada
A
la curva segmentada, se le llama, curva de coexistencia líquido –
Vapor.
Que representa el punto crítico
Desde
el punto de vista de la temperatura, el punto crítico representa la
temperatura máxima a la cual un elemento permanece en estado líquido, y
la presión crítica, es la presión medida a esta temperatura.