Gas
ideal : Una descripción macroscópica.
Hagamos
que cierta cantidad de gas esté confinada en un recipiente del volumen V.
Es claro que podemos reducir su dencidad, retirando algo de gas en el
recipiente, o colocando el gas en un recipiente más grande. Encontramos
experimentalmente que a densidades lo bastante pequeñas, todos los gases
tienden a mostrar ciertas relaciones simples entre las variables termodinámicas
p,V y T. Esto sugiere el concepto de un gas ideal,
uno que tendra el mismo comportamiento simple, bajo todas las condiciones
de temperatura y presión.
Dado
cualquier gas en un estado de equilibrio térmico, podemos medir su presión
p, su temperatura T y su volumen V. Para valores
suficientes pequeños la densidad, los experimentos demuestran que (1)
para una masa dada de gas que se mantiene a temperatura constante, la
presión es inversamente proporcional al volumen (ley de Boyle), y (2)
para una masa dada de gas que se mantiene a presión constante, el volumen
es directamente proporcional a la temperatura (ley de Charles y Gay Lussac).
Podemos resumir estos resultados experimentales por medio de la relación:
![]() una constante
(para una masa fija de gas).
una constante
(para una masa fija de gas).
El
volumen ocupado por un gas a una presión y temperaturas dadas, es
proporcional a la masa del gas. Así, la constante de la ecuación
![]() una constante, también debe ser proporcional
a la masa del gas, por ello escribimos la constante de la ecuación
una constante, también debe ser proporcional
a la masa del gas, por ello escribimos la constante de la ecuación
![]() una constante; como nR, donde n
es el numero de moles de gas en la muestra y R es una constante que
debe determinarse en forma experimental para cada gas. Los experimentos
demuestran que, a dencidades suficientes pequeñas, R tiene el
mismo valor para todos los gases, a saber,
una constante; como nR, donde n
es el numero de moles de gas en la muestra y R es una constante que
debe determinarse en forma experimental para cada gas. Los experimentos
demuestran que, a dencidades suficientes pequeñas, R tiene el
mismo valor para todos los gases, a saber,
R=8.314
J/mol K = 1.986 cal/mol K
R
se llama la constante universal de los gases. Con esto escribimos
la ecuación
![]() una constante, en la forma:
una constante, en la forma:
pV=nRT,
y
definimos a un gas ideal, como aquel que obedece esta relación bajo todas
las condiciones. No existe algo que seaen verdad un gas ideal, pero sigue
siendo concepto muy util y sencillo, relacionado realmente, con el hecho
que todos los gases reales se aproximan a la abtracción de los gases
ideales en su comportamiento, siempre que la densidad sea suficientemente
pequeña. pV=nRT se llama ecuación de estado de un gas
ideal.
Si
pudieramos llenar al bulbo de un termonetro de gas (ideal) a volumen
constante, un gas ideal, de veriamos, deacuerdo con la ecuación pV=nRT,
que podemos definir la temperatura en terminos de sus lecturas de
presión; esto es:
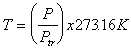 (gas
ideal).
(gas
ideal).
Aquí
![]() es la presión del gas en el punto triple del
agua, en el que la temperatura
es la presión del gas en el punto triple del
agua, en el que la temperatura
![]() es
por definición 273.16 K. En la practica, debemos llenar nuestro
termometro con un gas real y medir la temperatura extrapolando a la
densidad cero, usando la ecuación:
es
por definición 273.16 K. En la practica, debemos llenar nuestro
termometro con un gas real y medir la temperatura extrapolando a la
densidad cero, usando la ecuación:
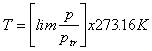 (gas
real).
(gas
real).